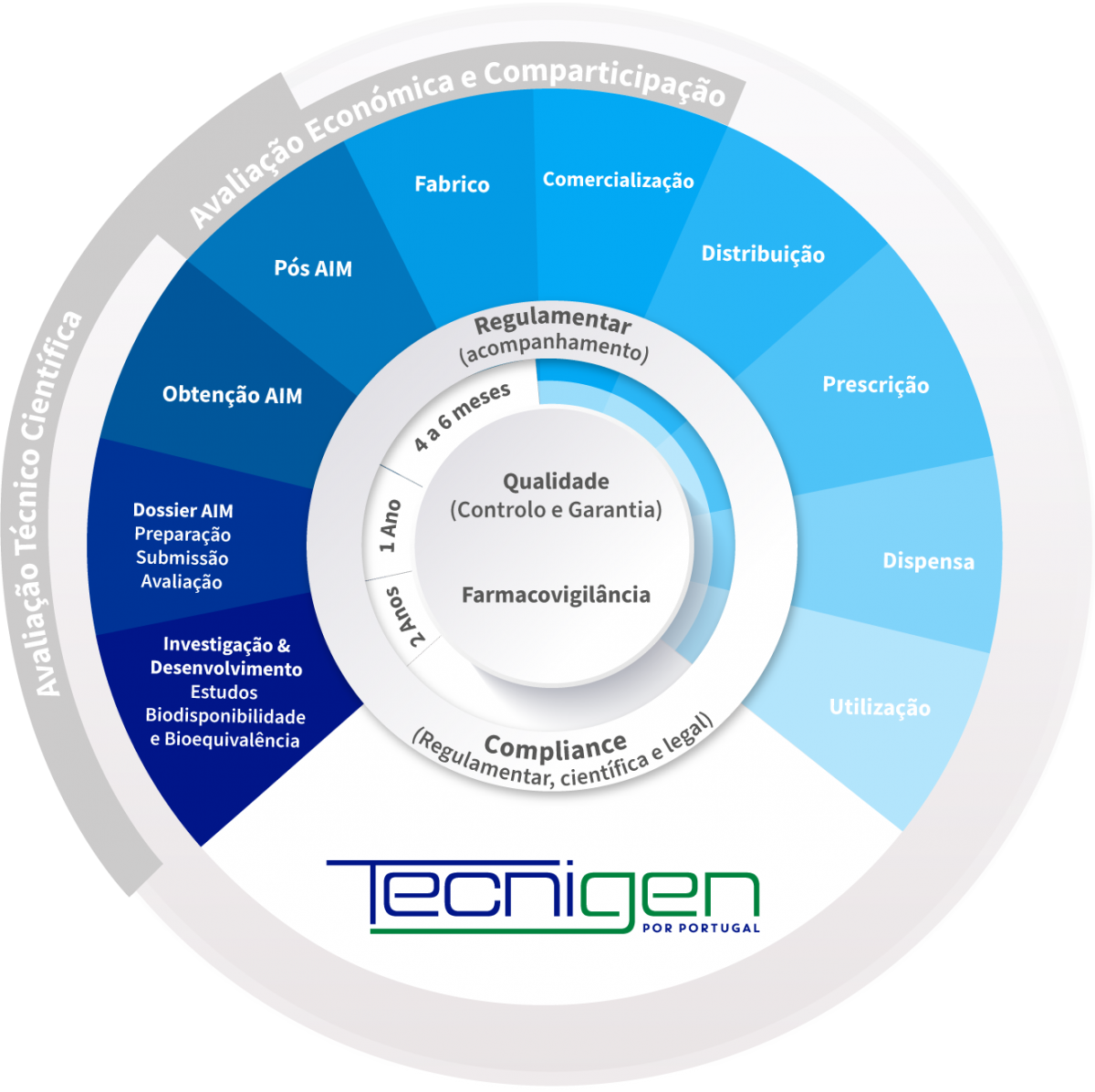
Tecnigen est une entreprise de génériques de dimension mondiale, 100 % portugaise, issue de la fusion de Farmoz et de Pentafarma.
Présente au Portugal, en Espagne et en Italie, Tecnigen suit la même ligne de différenciation que le Groupe Tecnimede : elle détient l’ensemble du cycle du médicament à usage humain, en se basant sur un important investissement en Recherche et développement dans son propre centre, Labor Qualitas, situé à Torres Vedras. Des médicaments génériques sont produits, également au Portugal, à l’aide d'une technologie de pointe chez Atlantic Pharma, située à Sintra.
Le portefeuille de Tecnigen est diversifié et complet et comprend des médicaments sur ordonnance, des médicaments sans ordonnance, des compléments alimentaires et des produits dermocosmétiques.
Tecnigen vise à établir et à promouvoir des partenariats durables avec ses clients, grâce à la création de modèles commerciaux adaptables et flexibles. Son objectif est également de consolider et de diversifier son portefeuille dans des domaines thérapeutiques importants et innovants et de continuer à être pionnière dans le lancement de nouveaux génériques.
Compte tenu de la taille et de la diversité du portefeuille, notre responsabilité envers les patients, les professionnels de la santé et le Service national de santé est aujourd’hui accrue, ce qui contribue à sa pérennité.
Nous pensons que la présence de la marque Portugal dans les transactions effectuées est essentielle pour générer de la valeur pour l'économie nationale.
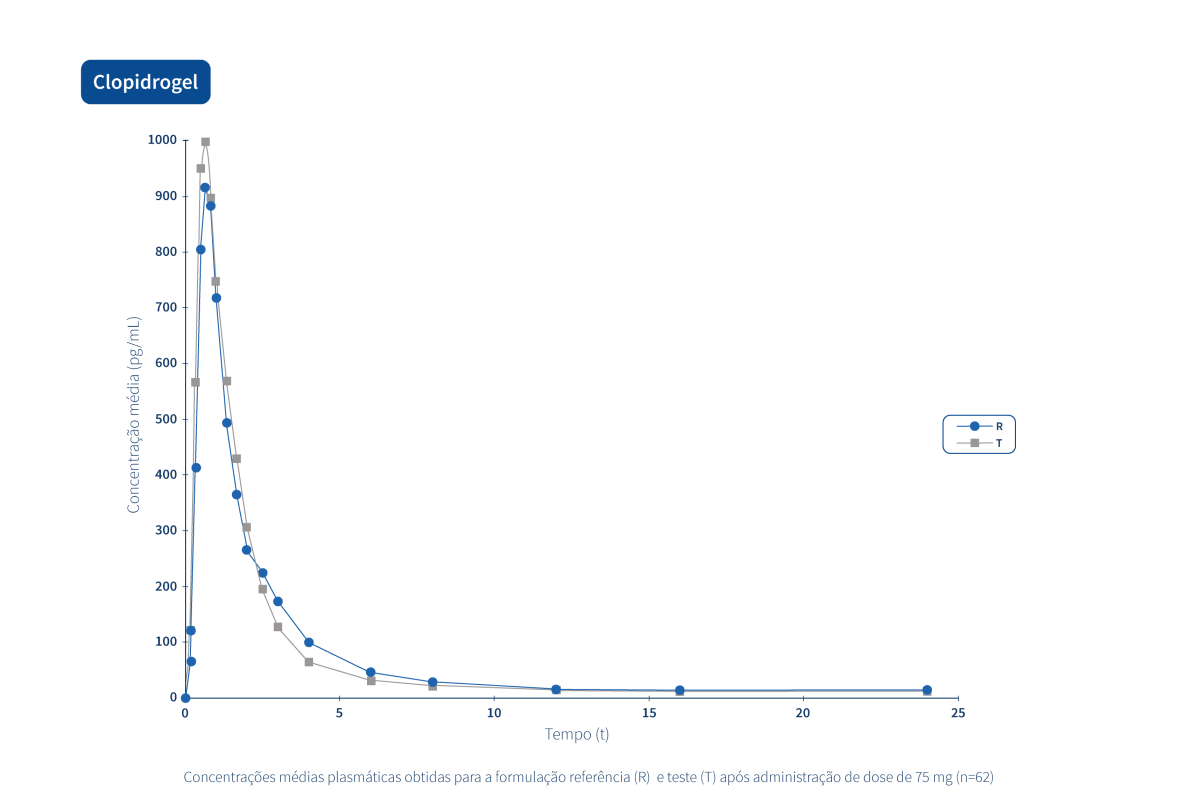
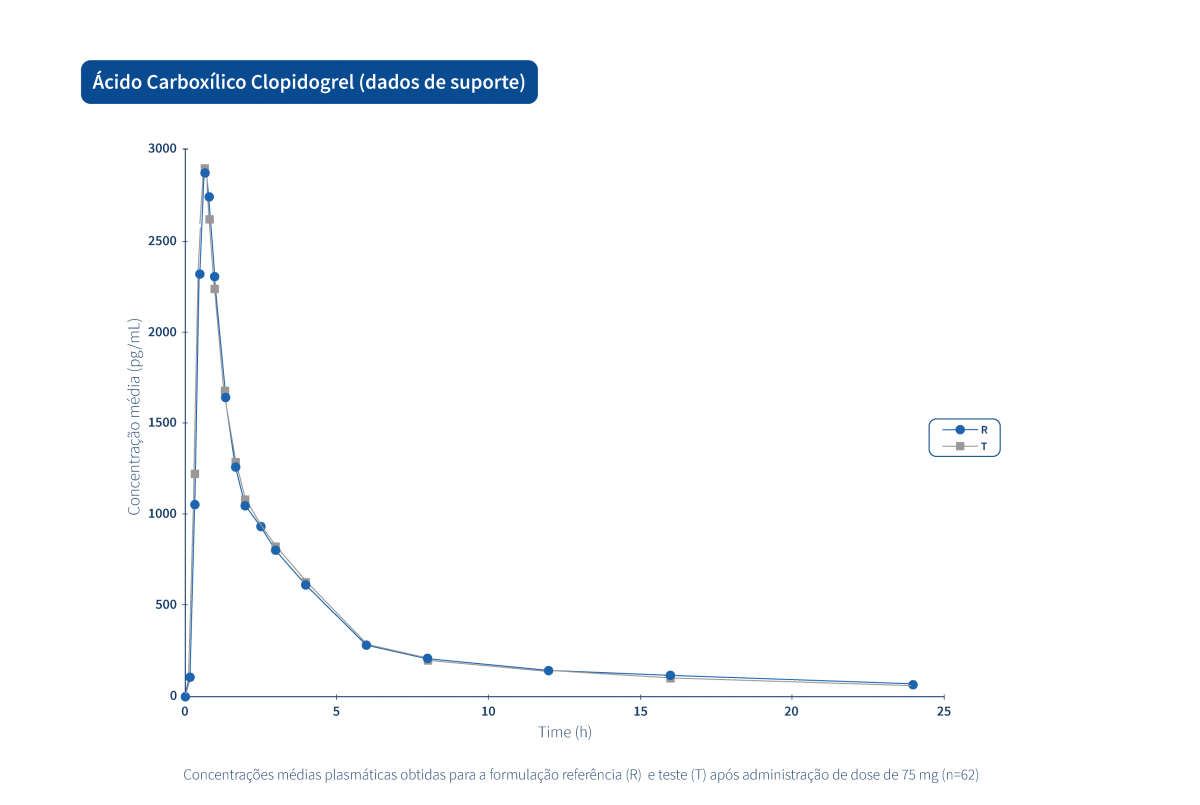
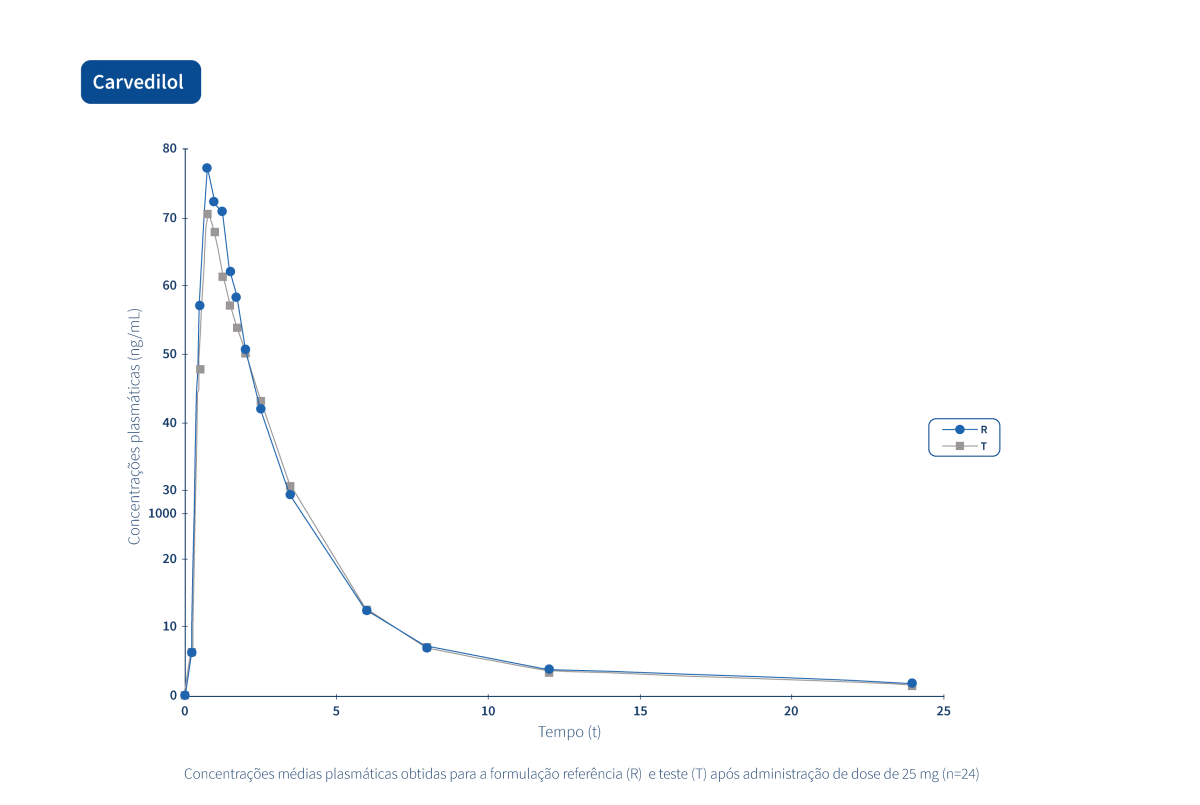
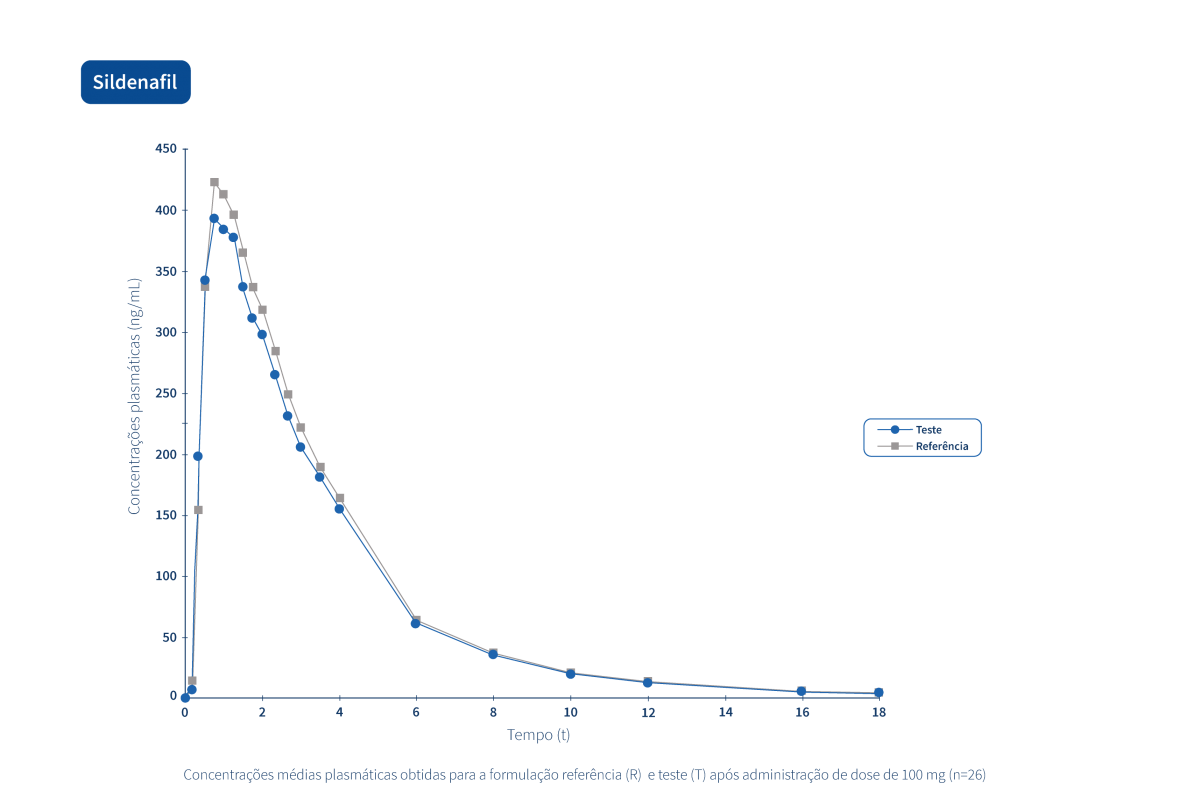
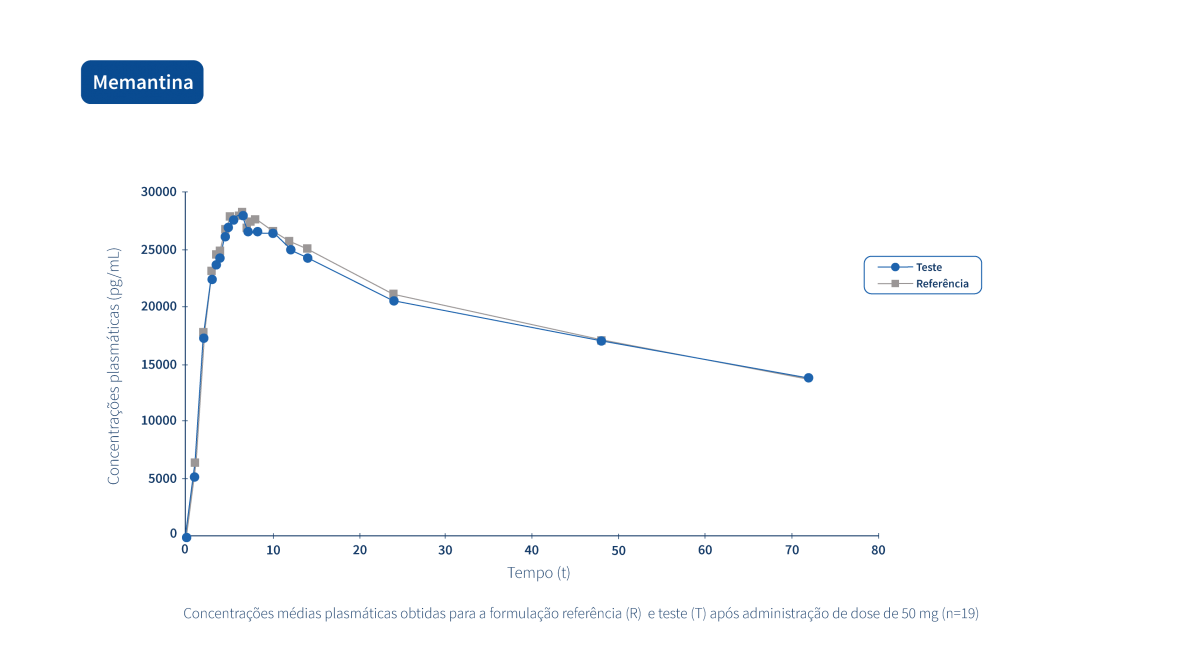
Un médicament générique est un médicament qui a la même composition qualitative et quantitative en principes actifs, la même forme pharmaceutique et dont la bioéquivalence avec le médicament de référence a été démontrée par des études de biodisponibilité appropriées.
Deux produits pharmaceutiques sont bioéquivalents s’ils sont équivalents du point de vue pharmacocinétique, c'est-à-dire si leur biodisponibilité (taux et extension de l'absorption) est similaire après administration à la même dose molaire. Par conséquent, le profil d’efficacité et d’innocuité doit être essentiellement le même. L’équivalence pharmaceutique implique la même quantité de la même substance active, sous la même forme pharmaceutique et la même posologie, par la même voie d'administration, en respectant des normes identiques ou comparables.*
Le Groupe Tecnimede soutient la réalisation d’études de bioéquivalence qui qualifient les médicaments génériques destinés au marché national et international.
Les graphiques suivants illustrent le travail intense de recherche clinique et de gestion intégrée de projets qui permettent au Groupe Tecnimede de fournir des médicaments essentiels pour le traitement et la prévention des maladies et des états cliniques les plus variés.
*Birkett DJ. Generics – equal or not? Aust Prescr 2003;26:85-7.
La pharmacovigilance englobe toutes les activités de surveillance de la sécurité des médicaments ayant une autorisation de mise sur le marché à travers la collecte et l'évaluation des notifications d’effets indésirables (ADR) reçues par le SNF (Système National de Pharmacovigilance), l'identification des risques liés à l’utilisation des médicaments, leur évaluation, la mise en œuvre des mesures de minimisation des risques et leur communication aux professionnels de la santé, aux patients, aux consommateurs et aux citoyens en général. Pour les problèmes de sécurité ou pour communiquer un effet indésirable possible lié aux produits Tecnigen, voyez comment procéder ici.